バースト高周波高電界の生体作用と医療への応用
1. はじめに生体細胞はさまざまな誘電物質の集合体とみなすことができる。細胞にバースト的な高周波高電界を印加すると、非熱的あるいは熱的、細胞膜あるいは細胞内部へのストレスのように、電界の強度、周波数および印加時間に相応した性質の異なる電気ストレスを細胞に与えることができる。本研究の目的は、高周波高電界に対する細胞応答を電界パラメータについて網羅的に調べること、そのメカニズムを明らかにすること、および、バイオ技術や医療への応用の可能性を検討することである。
2. 細胞内高電界の発生とその生体作用
生体細胞にステップ状に立ち上がる電界を印加すると、細胞内の器官やたんぱく質などの高分子は、それぞれの構造や帯電量などで決まる誘電的性質のため、電界に対して固有の反応緩和時間を有することが知られている。その中でも、特に、リン脂質からなる生体膜はその性質が特異的であり、外部電界の生体作用を大きく左右する。
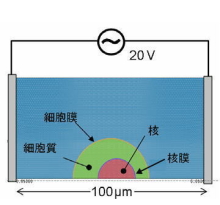
図1. 真核細胞の電界計算モデル(2次元)
図1は、外部電界に対する生体膜の影響を調べることを目的として、正弦波電界下の電界分布計算のために単純化された球形真核細胞モデルである。核を内包する直径40 μmの真核細胞を100 μmの電極間の導電性液体に浸した状態である。有限要素法を用いてこのモデルを解き、外部振動電界の周波数を振ると、細胞膜、核膜、細胞質および核内の電界強度は図2のようになる。
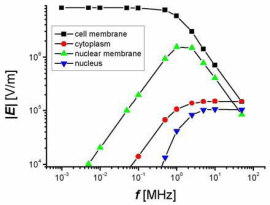
図2. 細胞内外電界分布の電界周波数依存性
100 kHz以下の周波数では印加電圧の殆どが細胞膜にかかり、細胞内には電界が殆ど存在しない。数100 kHzでは細胞内に電流が流れ始めるが、核膜が電流をブロックして核内には電流が流れにくい。1 MHzを超えると細胞内に比較的大きい電流が流れるようになる。この特性は、細胞膜などの生体膜がコンデンサとしてはたらくためであり、細胞内外に流れる電流分布が外部電界の周波数によって変わることに起因する。このように、電界の周波数によって細胞に与える作用が大きく変わる。すなわち、1 MHz程度よりも低ければ細胞膜に、大きければ細胞内により大きな電気刺激(ストレス)を与えることができる。また、電界の振幅と印加時間は、電界(非熱的)作用の大きさを決める重要な因子であると同時に、細胞内の温度上昇を決定する因子でもある。このように、周波数、振幅および印加時間を適当に選ぶことにより、細胞膜または細胞内、非熱的または熱的など、様々な物理作用を生体細胞に与えることが可能である。
時間幅数10 μs以上のパルス電界(周波数50 kHz以下に相当)によって細胞膜にストレスを与えて膜の透過性を増大させる方法は、エレクトロポレーションとして古くから知られている。これに対して、1 MHzを超える周波数で細胞内に誘導される1 kV/cmを超える電界あるいは10 A/cm2を超える電流密度は、細胞にとって未経験のストレスである。この細胞内電界によるストレスで新たな生体反応が期待される。また、細胞内の振動電界は、その周波数によって細胞内の特定の器官、分子あるいは構造に選択的にストレスを与えることが可能である。特に、たんぱく質のような弱い結合でできた3次元的構造体への特異的な作用が期待できる。
3. 高周波高電界による細胞内高電界の発生と細胞内DNAへの影響
細胞内電界を発生させるために電界に高周波成分を含ませる必要があり、従来はパルス電界が使われていたが、本研究では、正弦波振動電界をバースト的に用いる。このバースト正弦波高電界(IBSEF、図3)の利点は、周波数スペクトルが狭帯域であること、周波数、電界振幅とともに媒質に与えるエネルギー(温度上昇)を、精度良くかつ独立に制御できることである。
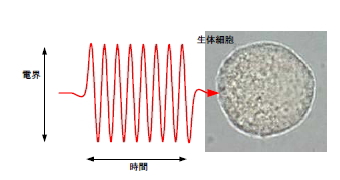
図3. バースト正弦波高電界(IBSEF)
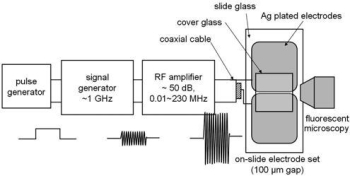
図4. IBSEF印加装置とその場観察システム
図4はIBSEFの発生装置の構成と電界印加するための電極およびその場観察システムである。周波数20 k ~230 MHz、最大振幅100 kV/cmの電界を任意の時間印加可能である。
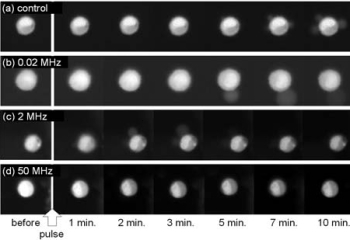
図5. IBSEF印加後のDNA結合色素の蛍光像の時間変化(電界周波数依存性)
図5は、振幅と印加時間をそれぞれ1 kV/cm、0.1 msとし、3種類の周波数の正弦波電界をチャイニーズハムスターの卵巣細胞(CHO細胞)に印加後、細胞内DNAの様子の時間変化を見たものである。発光は、予め細胞内に導入した、正常なDNAに結合する色素の蛍光である。上から、それぞれコントロール、20 kHz、2 MHz、50 MHzの場合である。
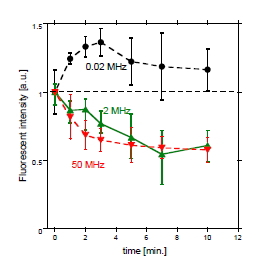
図6. IBSEF印加後のDNA結合色素の蛍光強度の時間変化(電界周波数依存性)
図6はIBSEF印加前のもので正規化した核内の平均蛍光輝度の時間変化である。20 kHzの場合は、IBSEF印加前後で蛍光輝度が増加するのに対し、2 MHzおよび50 MHzではIBSEF印加直後から輝度が減少し始める。20 kHz以下では細胞膜に穴が空いたため、細胞外の高密度の色素が細胞内に入ったためと考えられる。一方、2、50 MHzでは細胞内DNAが変質したと考えられる。従って、電界計算で予測されるように、電界の周波数1 MHz程度を境に、小さい周波数では細胞膜が損傷を受け、大きい周波数では細胞内に電界が生じて、細胞内物質に作用するということがわかった。
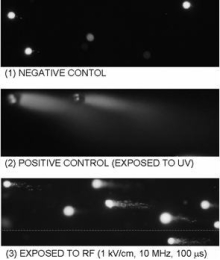
図7. コメットアッセイによるDNA損傷分析
図7はCHO細胞に100 MHzのバースト状高電界を印加した場合のDNAの損傷の様子を示す。細胞膜を溶かした後にそのまま電気泳動する、コメットアッセイ法を用いた分析結果である。細胞内のDNAが損傷して断片化していれば電気泳動の電界に引きずられて右側に尾を引く。(1)はコントロール、(2)は紫外線照射サンプル、(3)は周波数10 MHz、電界強度1 kV/cm、印加時間100 μsのIBSEFを印加した場合である。電界によってDNAが何らかの損傷を受けていることがわかる。しかも紫外線照射の場合とは尾のパターンが異なり、電界と紫外線ではDNA損傷メカニズムが異なることが示唆される。図8はコメットの長さの電界強度依存性であり、1 kV/cm程度の電界でDNAが損傷することが明らかとなった。
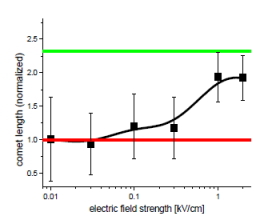
図8. コメットテール長さの電界強度依存性 (f = 100 MHz, t = 0.2 ms)
4. がん治療への応用 - アポトーシスの誘導
がん細胞は、正常な細胞で起こる自発的な死、すなわちアポトーシスが機能不全に陥っているために組織で無尽蔵に増殖する。多くのがん治療法は、がん細胞へのアポトーシス誘導することが基本的な考え方である。本研究のねらいは、IBSEFを利用してがん細胞の細胞内を直接電界で刺激してアポトーシスが誘導することである。本研究ではHeLa細胞と称するヒト子宮頸がん細胞を用いた。培養した細胞を並行平板電極内において、様々な条件のパルスを印加し、その後の反応をタイムラプス機能付き顕微鏡で観察した。図9はIBSEF印加後6時間培養したHeLa細胞である。コントロールと比べると細胞数が明らかに異なるほか、アポトーシスの過程でよく見られる細胞断片化を起こしている細胞が見られる。
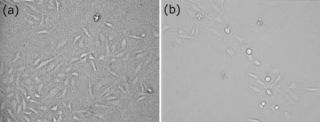
図9. IBSEF印加24時間培養後のHeLa細胞
(a) コントロール、(b) IBSEF (2 kV/cm, 50 MHz, 0.2 ms)
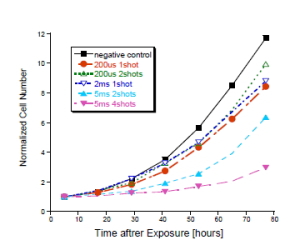
図10. IBSEF印加後の生存細胞数の時間変化
図10は細胞印加5時間後の細胞数を基準に細胞の増殖活性を示す。5時間後の細胞数もIBSEFを印加した方が少ないことを付け加えておく。コントロールに比べて明らかに増殖活性が低下している。しかも、印加時間が長い方が活性度は低い。ただし、この場合は印加時間とともに温度上昇も増加するので、電界と温度のどちらの効果が支配的か慎重に吟味する必要がある。いずれにしても、これらはパルス的なエネルギー照射の効果であり、極めてユニークな生体反応である。
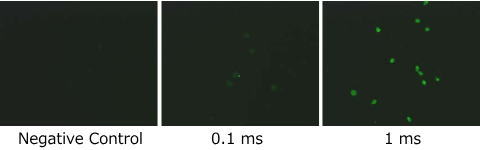
図11. 高周波高電界印加CHO細胞のTUNEL分析結果 (E = 1.5 kV/cm, f = 100 MHz)
図11は、アポトーシスで特徴的なDNA断片化を検出するTUNEL法を用いてIBSEF(1.5 kV/cm、50 MHz)を印加した細胞を分析した結果である。IBSEFを印加することによって明らかにアポトーシス様のDNA断片化が起こっていることがわかる。この場合も印加時間が長いほどアポトーシス様のDNA断片化が強く発生する傾向がある。印加時間0.1、1 msの場合、温度上昇がそれぞれ0.3、3℃であり、印加電界の非加熱的生体効果は少なからずあると考えられる。
このように、IBSEFによってアポトーシスを誘導できる可能性を示した。今後、生体内電界がアポトーシスを発生させるメカニズムの解明と電界パラメータ依存性を調べる予定である。また、がん治療を実用化するためには、体内へ高周波電界を導入する機構の開発が不可欠である。